عناصر کم مصرف
عناصر غذایی کم مصرف برای رشد گیاه ضروری هستند ، اما در مقادیر بسیار کمتری نسبت به عناصر غذایی پرمصرف مورد نیاز هستند. هشت ریز مغذی عبارتند از: بر (B) ، کلرید (Cl) ، مس (Cu) ، آهن (Fe) ، منگنز (Mn) ، مولیبدن (Mo) ، نیکل (Ni) و روی (Zn).
به دلیل اینکه فقط یک منبع محدود از این عناصر غذایی کم مصرف در خاک وجود دارد ، انتظار می رود کمبود ریز مغذی ها با گذشت زمان شایع تر شود ، به خصوص اگر مواد آلی خاک همچنان رو به کاهش باشد ، کود دامی به خاک اضافه نشود و اکثریت گیاه برداشت شده و ضایعات آن نیز از مزرعه جمع آوری شود.
پنج مورد از عناصر کم مصرف (مس ، آهن ، منگنز ، نیکل و روی) از فلزات هستند و لذا در آب خاک به صورت یون هایی با بار مثبت هستند(کاتیون ها). فلزات تمایل دارند به طور مشابه در خاک رفتار کنند و در ابتدا مورد بحث قرار خواهد گرفت. سه عنصر کم مصرف دیگر (B ، Cl ، Mo) به صورت مولکول هایی با بار خنثی یا منفی در آب خاک وجود دارند (که در اینجا به آنها «عناصر کم مصرف آنیونی» گفته می شود) ، و پس از فلزات مورد بحث قرار می گیرند.
چرخه عناصر کم مصرف - چرخه فلزات
فلزات به یکی از چهار شکل در خاک وجود دارند: معدنی ، آلی ، جذب شده(با خاک) یا محلول. بیشتر فلزات موجود در خاک به مواد معدنی و آلی (OM) متصل بوده و در دسترس گیاهان نیستند. فلزات جذب شده نیز سومین بخش را تشکیل می دهد و به طور کلی اتصال مخکمی با سطح خاک دارند. اگرچه فلزات معدنی ، آلی و جذب شده بلافاصله برای گیاه قابل جذب نیستند ، اما می توانند به آرامی به محلول خاک آزاد شوند. غلظت فلزات محلول که شکل چهارم هستند معمولاً بسیار کم است.
غلظت فلزات موجود در گیاه را می توان با یک عصاره آلی مانند DTPA می توان تخمین زد. غلظت کل فلزات در خاک (که با استخراج توسط اسیدهای قوی مشخص می شود) به طور کلی به میزان زیادی بیشتر از فلزات قابل جذب برای گیاه است(جدول 1). مهمتر از همه ، غلظت آهن قابل جذب کمتر از 0.1٪ میانگین غلظت کل آهن خاک را نشان می دهد.
فرآیندهای تعیین کننده مقدار فلزات قابل جذب در محلول خاک عبارتند از: جذب گیاه ، جذب / دفع ، رسوب / انحلال ، معدنی شدن / بیحرکتی ، فرسایش و برداشت محصول (شکل 1).
جدول 1- غلظت کل فلزات ضروری و غلظت قابل جذب بودن آنها در مونتانای آمریکا
| فلز | متوسط غلظت کل در خاک(ppm) | متوسط غلظت آزمایش خاک(ppm) |
| مس | 30 | 2 |
| آهن | 38000 | 15.8 |
| منگنز | 600 | 12.4 |
| نیکل | 40 | *** |
| روی | 50 | 1.2 |
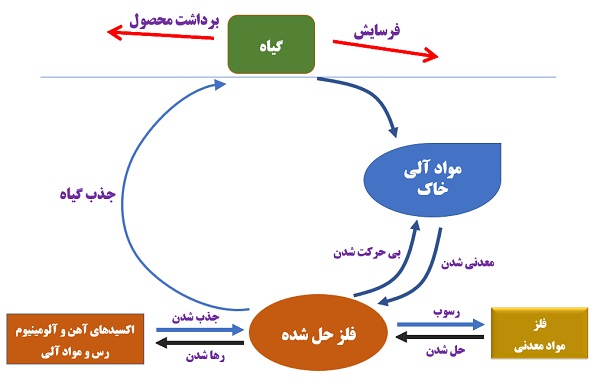
تصویر1- چرخه فلزات کم مصرف
جذب توسط گیاه
گیاهان فلزات را به صورت کاتیون جذب می کنند (یونهای با بار مثبت و حل شده). مقدار معمول جذب توسط محصول دارای دامنه ای از کمتر از حدود 0.1 کیلوگرم در هکتار برای نیکل و مس تا حدود 0.5 کیلوگرم در هکتار برای آهن می باشد اگرچه این مقادیر تا حدود زیادی به محصول بستگی دارد. تراکم فلزات ضروری در ماده خشک بافت گیاهی بین تقریبا 0.5 ppm برای نیکل تا 100 ppm برای آهن می باشد که این مقدار نیز براساس نوع گونه گیاهی بسیار متغیر است. برای مقایسه، تراکم ازت در بافت خشک گیاهی تقریبا 10000تا 50000 ppm است. با اینکه تراکم فلزات به طور قابل توجهی نسبت به تراکم ازت کمتر است اما آنها به طور حتم برای وظایف سلولی و رشد گیاه ضروری هستند.
جذب فلزات توسط گیاهان تا حدودی به غلظت سایر مواد مغذی وابسته است. برای مثال، غلظت زیاد مس، منگنز، مولیبدن، نیکل یا روی سبب کمبود آهن شده است. به علاوه، گیاهانی که کود نیترات دریافت کرده اند نسبت به آنهایی که کود آمونیوم دریافت کرده اند شانس بیشتری برای کمبود آهن خواهند داشت آن هم به دلیل تفاوتهای PH در منطقه ریشه است.
جذب فلزات به طور قابل ملاحظه ای بین محصولات تغییر می کند و حتی بین نوع واریته و رقم یک محصول نیز این موضوع صادق است. برای مثال، در خاک هایی که کمبود روی دارند چاودار ، روی را تقریبا 40 درصد کمتر از گندم زمستانه جذب می کند. با این حال در خاکی که کود روی دریافت کرده چاودار تقریبا 60 درصد بیشتر از گندم زمستانه روی را جذب کرده است. از بین 5 غله دانه ریز و براساس مقایسه تولید ماده خشک اندام های هوایی (ساقه یا shoot) در خاک آهکی، گندم دروم ظاهرا بیشترین تاثیر را به وسیله کمبود روی داشته است.
یک مطالعه مشابه بر روی 13 گونه یونجه نشان داد که گیاهانی که در خاک های کمبود روی رشد می کنند ، بیوماس اندام های هوایی خشک شده 68 تا 85 درصد کمتر از زمانی بود که این محصولات در خاک های مشابه که کود روی دریافت کرده بودند داشتند. نتایج آرمایشات دیگر نشان می دهد که جذب روی و حساسیت به خاک هایی که کمبود روی دارند وابستگی زیادی به محصول و رقم دارد.
تراکم فلز محلول در خاکی که ماده آلی بسیار کمی دارد می تواند کمتر از مقدار لازم برای رشد کافی گیاه باشد ، که نشان دهنده اهمیت ماده آلی در افزایش قابل دسترس بودن و جذب عناصر فلزی کم مصرف است. چرا ماده آلی به افزایش حلالیت و جذب گیاهی فلزات کمک می کند؟ "کلاته کردن" (chelation) فرایندی است که یک ماده آلی حل شده یا "کلات"(chelate) (به معنای "پنجه مانند" - claw-like) به یک کاتیون فلزی متصل می شودتا کمپلکس فلز- آلی محلول را تشکیل دهد. این امر منجر به افزایش آزادسازی یا حل شدن کاتیون فلزی می شود. به طور خاص ، کلاته کردن می تواند غلظت آهن محلول را بیش از 100 برابر افزایش دهد ، در غیر این صورت آهن کافی برای جذب گیاه در سطح pH نزدیک به 8 وجود نخواهد داشت. نمونه هایی از "کلات ها" هومات ها و فولوات ها ( humates and fulvates)هستند. هر دو به طور طبیعی در اکثر خاک ها یافت می شوند ، زیرا آنها فرآورده های تجزیه ماده آلی هستند. کلات ها همچنین در "تراوه (exudates ) ریشه یافت می شوند (مواد آلی که از ریشه ها دفع می شود) ، که می تواند دسترسی سریع فلزات اطراف ریشه های گیاه را افزایش دهد. روش های مدیریتی که باعث افزایش مواد آلی خاک می شود مانند کشاورزی بدون شخم یا استفاده از کود دامی، می تواند درجه کلاته کردن را افزایش داده و در نتیجه میزان دسترسی به فلز را افزایش دهد.
جذب و آزادسازی فلزات
فلزات اتصال قوی دارند زیدا به طور معمول دارای بار مثبت بوده و سطوح ذرات خاک (رس و ماده آلی) بار منفی دارند. برای مثال، 4 تا از 5 فلز ضروری در PH 7.5 بار مثبت دارند(آهن فرو و فریک، منگنز، نیکل و روی) . مس در PH 7.5 در شکل غالب یعنی هیدروکسید مس CU(OH)2 می باشد که با خنثی دارد اما این فلز نیز دارای دو شکل عمده +Cu2 و +Cu3 می باشد که بلر مثبت داشته و هر دو شکل، با ذرات خاک اتصال قوی بر قرار می کند و به دنبال آن، تراکم مس محلول کاسته می شود. فلزات به ذرات رس و ماده آلی و هیدروکسید آهن و منگنزو آلومینیوم متصل یا جذب می شود. جذب فلزات به طور مستقیم با ظرفیت تبادل کاتیونی خاک ارتباط دارد.
سطح ذرات مواد معدنی در PH بالاتر، بار منفی بیشتری دارا خواهند بود که این حالت سبب جذب و اتصال بیشتر فلزات می شود. در PH نزدیک 8، غلظت آهن محلول کمترین مقدار است که برای فلز روی این حالت در PH نزدیک 9 رخ می دهد که دلیل آن مربوط به جذب قوی تر و انحلال کمتر در PH بالا می باشد.
انحلال و رسوب فلزات
فلزات معدنی می توانند در شرایط خاص محیطی به آرامی حل شوند و از این طریق فلزات ، در محلول خاک آزاد می شوند. به عنوان مثال ، هیدروکسیدهای آهن و منگنز که در خاک بسیار رایج هستند در شرایط غرقاب یا سیلاب به دلیل کمبود اکسیژن، حل می شوند و سپس در شرایط خشک تر رسوب می کنند. این فرآیند باعث می شود خاک ها "چند رنگی" (Mottled) شوند یا با رنگ های قرمز و خاکستری لایه بندی شوند. هیدروکسیدهای فلزی با افزایش pH کمتر حل می شوند. بنابراین ، کمتر احتمال دارد که کمبودهای فلزی در pH پایین رخ دهد.
با توجه به وابستگی pH به حلالیت مواد معدنی فلز ، غلظت آهن محلول، به ازای هر واحد افزایش در pH می تواند بیش از یک فاکتور 100 کاهش یابد (یعنی اگر pH از 5 به 6 برسد). کل غلظت آهن محلول در pH نزدیک به 7.5 به حداقل می رسد (تصویر 2) ، به همین دلیل کمبود آهن در خاک های با pH بالا بسیار متداول است. با افزایش pH ، سرانجام حلالیت فلز افزایش می یابد.
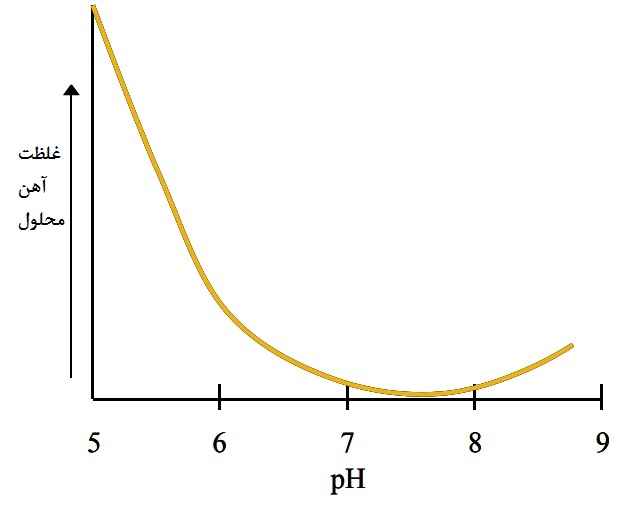
تصویر 2- اثر pH خاک بر روی علظت آهن محلول- غلطت حقیقی آهن بستگی به درجه کلاته کردن دارد
تثبیت شدن (بی حرکت شدن) و معدنی شدن
باقیمانده محصولات زراعی ، مواد آلی اضافه شده (مانند کود دامی) و ارگانیسم های خاک با گذشت زمان تجزیه می شوند و فلزات را در فرآیندی به نام معدنی شدن به محلول خاک رها می کنند. در مقابل ، میکروارگانیسم ها می توانند فلزات را جذب کرده در نتیجه باعت تثبیت ( بی حرکت) شوند.مقادیر نسبی معدنی شدن و تثبیت، اغلب به نسبت های کربن تا ازت یا کربن به فسفر در پسمانده های آلی بستگی دارد. به طور کلی ، اعتقاد بر این نیست که غلظت عناصر کم مصرف میزان معدنی شدن را کنترل می کند بلکه درجه حرارت پایین و رطوبت کم باعث کاهش معدنی شدن و تثبیت می شود ، زیرا هر دو عامل بر سرعت رشد میکروبی تأثیر می گذارند. انتظار می رود که کارهایی که می توانند سرعت معدنی شدن را افزایش دهند از قبیل استفاده از کود نیتروژن ، شخم زدن، آبیاری و افزدون کود دامی ،آزادسازی فلزات قابل استفاده برای گیاه را افزایش دهند.
فرسایش و شسته شدن
فرسایش خاک باعث از بین رفتن فلزات کم مصرف از مزارع خواهد شد زیرا فلزات به خاک محکم متصل می شوند. علاوه بر این ، تراکم فلز به طور کلی در افق فوقانی نسبت به افق های پایین در مونتانا بیشتر است و این اثر را بیشتر می کند. بنابراین ، روشهای طراحی شده برای کاهش فرسایش خاک باعث کاهش تلفات فلزات از طریق فرسایش نیز می شوند. کاهش از دست رفتن خاک و فلزات موجود در آن خاک ، ممکن استبرای بهبود کیفیت آب سودمند باشد که یک مشکل زیست محیطی می باشد. شسته شدن فلزات از خاک، به طور کلی چندان مورد توجه نیست زیرا آنها جذب و اتصال محکمی با ذرات خاک دارند.
عناصر کم مصرف آنیونی
عناصر کم مصرف آنیونی شامل بر (B) ، کلرید (Cl) و مولیبدن (Mo) می باشد. کلر و مولیبدن به طور کلی به صورت آنیون در خاک وجود دارند ، در حالی که بر به طور کلی به صورت یک اسید بدون بار (H3BO3o) وجود دارد ، اگرچه در pH بالاتر می تواند به صورت یک آنیون وجود داشته باشد. تغییرشکل هایی که عناصر کم مصرف آنیونی دستخوش آن می شوند مشابهعناصر کم مصرف فلزی با برخی موارد استثنای عمده است که، عمدتا به دلیل اختلاف بار است. به عنوان مثال ، Cl و B احتمال شسته شدن بسیار بالاتری نسبت به فلزات دارند زیرا آنها بار مثبت ندارند و به راحتی به ذرات خاک رس متصل نمی شوند. علاوه بر این ،بیشتر Cl موجود در خاک برای جذب گیاه در دسترس است. B به طور عمده در مواد معدنی موجود در خاک وجود دارد ، اما به نسبت بیشتر از عناصر کم مصرف فلزی قابل جذب برای گیاه است. سرانجام ، مولیبدن به طور عمده در مواد معدنی یافت می شود یا به شدت به سطوح ذرات خاک متصل می باشد. عواملی که بر معدنی شدن ، تثبیت و فرسایش عناصر کم مصرف آنیونی تأثیر می گذارد ، همان مواردی است که در بالا برای عناصر کم مصرف فلزی شرح داده شد.
ادامه دارد
منبع:
http://landresources.montana.edu/nm/documents/NM7.pdf



























